Si recordamos, de nuestros estudios de educación primaria, podemos darnos cuenta de lo fundamental que es el tema de la geoquímica de aguas continentales. En números, sólo el 4% del agua del planeta es agua dulce, de la que depende nuestra supervivencia. También sabemos cómo de importante es este recurso para el desarrollo humano y lo poco equitativo de su reparto, así como los problemas con la calidad del mismo.Como en los ciclos biogeoquímicos de los elementos, las actividades antrópicas también tienen una grave influencia negativa en el ciclo biogeoquímico general del agua, y muchas de las modificaciones tienen que ver con su composición química en las aguas continentales o dulces. Del total del agua que discurre en los continentes, los 20 ríos más grandes transportan el 40% (sólo el Amazonas ya contribuye con un 15% del total). Estos ríos nos muestran que los metales que dominan disueltos como cationes son sólo cuatro: Ca2+, Na+, K+ y Mg2+, y su concentración es baja. Los aniones más comunes son Cl‐, HCO ‐ y SO 2‐. Otra evidencia es que, aunque la composición iónica disuelta de las aguas de estos ríos deriva del proceso de meteorización, ésta difiere radicalmente de la composición de la corteza continental (Andrews et al. 2004), dado que, esencialmente, el Al y el Fe son muy poco solubles comparados con otros metales, como ya hemos explicado en anteriores módulos. Estas afirmaciones sirven en gran medida también para las aguas subterráneas, aunque las composiciones de unas y otras no son exactamente iguales.
Este artículo corresponde a un fragmento de uno de los módulos del “Curso de introducción a la geoquímica aplicada“.
Contenido
Procesos que controlan la composición de las aguas marinas
En márgenes continentales
Los procesos químicos que tienen lugar en el océano abierto son distintos que los que tienen lugar en las aguas de los márgenes continentales, tanto por los procesos físicos y biológicos que en ellos influyen, como por la mezcla de aguas dulces y saldas que suele tener lugar en estos márgenes. Estos medios marginales son los estuarios (zonas de mezcla de aguas dulces y saladas) y las cuencas semiaisladas (o lagoons). Estas zonas marginales son muy interesantes desde el punto de vista ambiental, no solo por la riqueza de los medios para la producción biológica, sino también por ser las zonas de influencia de las actividades antrópicas. Muchas grandes ciudades y zonas portuarias e industrias, vierten sus deshechos a este medio marginal del océano.
Curso de introducción a la geoquímica aplicada
En los estuarios, los procesos van a estar controlados no solo por el gran gradiente de fuerza iónica que se da al mezclar el agua dulce de los ríos con el agua salada del mar, sino que en ocasiones este gradiente va a ir acompañado de otro gradiente de pH. También se va a dar un cambio en el régimen de flujo de las aguas, que va a pasar de ser unidireccional en el río a bidireccional (por mareas) en el mar. En las mareas alta y baja, la velocidad del flujo se hace cero, por lo que el 95% de los sedimentos finos en suspensión se depositan, siendo estos principalmente, arcillas. Esto va acompañado de la desestabilización de los coloides, que floculan y también se depositan con el gradiente de fuerza iónica. De todos modos, este sedimento se redistribuye constantemente por las corrientes de marea, formando una región con mucha turbidez debido a toda la cantidad de partículas en suspensión. En esta región de turbidez máxima se dan muchas reacciones de intercambio de especies entre las partículas y las aguas.
En estos medios también se dan procesos de mezcla, pero como hemos explicado anteriormente, no todos los iones se comportan, o se mezclan, de una manera conservativa (relación linear). En los estuarios, debido a su dinámica, no se puede establecer una localización geográfica por lo que se usa el valor de la salinidad para ubicar un punto de interés, por ejemplo, para observar estos procesos de mezcla. De esta manera se estudian diagramas concentración – salinidad para observar si las relaciones de mezcla son o no conservativas.
Cerca de los continentes también podemos encontrar aguas en cuencas semi‐aisladas en las que una barrera separa la cuenca del mar abierto. Esta barrera tiene una depresión por la cual se produce el intercambio de agua con el mar abierto. En estas cuencas los procesos también son peculiares y dependen en gran medida del régimen de circulación de las aguas. Este va a definir las propiedades de la columna de agua en la cuenca, incluso su composición química. En función de la profundidad de la cuenca y del conducto de la barrera por donde se comunica con el mar abierto, habrá cuencas donde el proceso de evaporación sea más rápido que el de precipitación, en este caso la circulación se da en toda la profundidad de la cuenca. Sin embargo, si la precipitación es más rápida que la evaporación, la circulación será solo superficial y solo se da en las capas de agua más someras, hasta la profundidad máxima de la depresión de la barrera. En el primer caso la cuenca entera contendrá aguas oxigenadas debido a la circulación completa en toda su profundidad, mientras que en el segundo las aguas de estas cuencas suelen estar estancadas en profundidad, y si contienen materia orgánica, pueden alcanzar condiciones anóxicas.Por último, sin olvidar la producción primaria del fitoplancton y la descomposición de la materia orgánica por medio de las bacterias heterótrofas, en los estuarios se da el proceso de halmirolisis, por el cual los materiales terrestres se adaptan a las condiciones marinas: de un medio con baja fuerza iónica con predominio de Ca2+ y HCO ‐ a un medio con alta fuerza iónica y con predominio de Na+ y Cl‐. En este proceso, los intercambios iónicos son muy importantes y aumentan el número de reacciones que se dan en estos complejos medios.
En el caso de estuarios y cuencas semi‐aisladas es interesante calcular el tiempo de lavado o flushing time, por su aplicación en caso de entrada de contaminantes en estos medios. Para poder eliminar o conocer cuando desaparecerá el contaminante, nos interesa conocer cuánto tiempo tarda en producirse el intercambio del agua contaminada con la no contaminada, tanto si es la del río o la del mar. Este tiempo se puede calcular de diferentes maneras, según se explica en el manual de Eby (2004). En cualquier caso, se consideran especies conservativas, es decir, no hay adición o eliminación de esa especie por otros procesos en la columna de agua.
Para el cálculo, también se asume un estado estacionario en el que no hay una continua entrada del contaminante y que este se encuentra distribuido uniformemente en la capa de interés.
Si el agua es introducida solamente por el flujo procedente de un río y hay una capa superficial bien desarrollada en el medio de mezcla, se puede establecer que:
Tiempo de lavado = F/R (6‐3)
Donde F es el volumen de la capa superficial y R es la velocidad de flujo de agua que se añade a esa capa.
Si la cuenca tuviera, sin embargo, una buena circulación vertical, el contaminante se mezclará en toda la cuenca y si la entrada de agua predominante procediera del mar abierto (por ejemplo en un estuario con un flujo mareal superior al flujo del río o en una cuenca semi‐ aislada donde predomina la evaporación sobre la precipitación), podríamos calcular el tiempo de lavado según:
Tiempo de lavado = V/T0 (6‐4)
Donde V es el volumen de agua contaminada y T0 es el flujo de la cuenca hacia el mar abierto.
Estos tiempos de lavado son mínimos, ya que consideramos que no hay mezcla de las aguas contaminadas con las limpias. Si se considera la mezcla, se puede calcular el tiempo con un método iterativo considerando varios momentos de entrada de agua limpia y considerando que, en cada entrada, se produce la mezcla total. Como resultado tendríamos que hay una dilución de la concentración del contaminante igual al volumen del agua contaminada divido por la suma de este volumen de agua contaminada más el volumen de agua limpia. Con sucesivas entradas de agua limpia, se produce la disminución de la concentración del contaminante. Si, por el contrario, se produce una entrada continua de contaminante, se haría lo mismo con la entrada, observándose un incremento de la concentración del contaminante hasta alcanzar un estado de equilibrio estacionario.
En mar abierto
Los principales procesos que tienen lugar en este ambiente tienen que ver con la actividad biológica y con las interacciones del agua del mar con los sedimentos y los basaltos del fondo oceánico.
La actividad biológica, como ya hemos visto en anteriores ocasiones, tiene que ver principalmente con la actividad fotosintética y la degradación, por oxidación, de materia orgánica por bacterias heterótrofas.
La ecuación que puede resumir el proceso de fotosíntesis, por el que se produce materia orgánica a partir de CO2 y H2O es:
106 𝐶𝑂2 + 16𝑁𝑂– + 𝐻𝑃𝑂2– + 122 𝐻2𝑂+ 18 𝐻+ → (𝐶106𝐻263𝑂110𝑁16𝑃1)protopSacna aSga + 139𝑂2
3 4
(6‐5)
La proporción entre P:N:C se denomina la proporción de Redfield. Como la cantidad de CO2 y H2O es muy abundante en las aguas, son el P y el N los que funcionan como factores limitantes para la producción primaria de materia orgánica.
La proporción Redfield se mantiene también para otros elementos que actúan como trazas, y en ocasiones pueden limitar el crecimiento si están ausentes o en muy baja proporción, como es el caso del Fe. En la fórmula también influye, aunque no lo hemos señalado, la radiación solar, que todos sabemos puede ser también un factor limitante en algunas latitudes según la época del año.
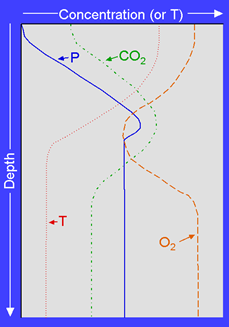
El proceso de fotosíntesis se restringe a las zonas más someras de las aguas oceánicas, hasta donde penetra la luz solar. A esta zona se le denomina eufótica. Esta zona se puede ver reducida si la actividad biológica es tan intensa que la cantidad de materia orgánica bloquea el paso de luz a zonas más profundas. En estas zonas someras, se consume CO2 y se produce O2, llegando incluso a superarse los niveles atmosféricos de este gas. Los elementos que funcionan como nutrientes (N y P) se van consumiendo, por lo que su abundancia puede ser un factor limitante para el crecimiento del fitoplancton. Los niveles de CO2 vuelven a aumentar en la zona donde los organismos heterótrofos consumen materia orgánica liberando este gas. Así que por debajo de la zona de fotosíntesis se consume O2 y se libera CO2. Al transportarse la materia orgánica hacia zonas más profundas, bien directamente o como producto de deshecho de los heterótrofos, en esas zonas aumentará de nuevo la cantidad de nutrientes. Estas variaciones se muestran en la figura 6.4. Vemos como la temperatura desciende bruscamente en un nivel que se denomina termoclina, por debajo de la cual se encuentran las aguas del océano profundo, donde los niveles de CO2 y O2, son similares a los de origen. Una vez conocida esta distribución vertical, comprenderemos cómo los procesos de upwelling o ascenso de aguas profundas, pueden transportar nutrientes a zonas someras donde los organismos pueden aprovecharlos generando una alta producción biológica.
En las aguas del océano profundo no solo hay depósito de partículas de materia orgánica. Hay partículas de conchas carbonatadas o silíceas y variedad de minerales silicatados, esencialmente cuarzo y arcillas procedentes de los continentes. Hay, por tanto, también, interacciones entre el agua del mar y los sedimentos. Algunas de estas partículas pueden estar recubiertas de oxi‐hidróxidos con carga negativa (debido al pH del agua del océano), por lo que son capaces de retener cationes por adsorción. En las soluciones con alto valor de la fuerza iónica, los cationes monovalentes tienden a intercambiarse por divalentes, por lo que el Na+ del océano se intercambiará con divalentes en los minerales arcillosos.
Por debajo de la interfaz entre el agua y los sedimentos del fondo marino, el potencial redox puede llegar a ser bajo, no como en la columna de agua donde siempre hay aguas oxigenadas.
Esto va a depender de la cantidad de materia orgánica disponible en el sedimento. En estos ambientes pueden tener lugar las reacciones de oxidación de las que ya hemos hablado en módulos anteriores como la reducción de nitratos, de óxidos de manganeso, la reducción de sulfato, etc…y que debemos recordar que estaban catalizadas por microorganismos. En la reducción de sulfatos, por ejemplo, se da también la precipitación de sulfuros metálicos, secuestrando de esta manera metales de las aguas y eliminando sulfato de las aguas.
Por último, las aguas del océano interaccionan con los basaltos de los fondos oceánicos formados en las dorsales centrooceánicas en las zonas de rift, donde las temperaturas pueden alcanzar hasta los 400 ºC. Estas interacciones se dan en los sistemas hidrotermales, que pueden ser de alta o baja temperatura en función de la distancia lateral al centro de emisión magmática (Fig. 6.5). Las reacciones que ocurren en estos sistemas son diferentes, pero en todos tienen lugar procesos de meteorización o metasomatismo (metamorfismo no isoquímico) de los minerales que constituyen los fondos oceánicos, esencialmente olivino, piroxeno, plagioclasa y vidrio volcánico, que son muy inestables en contacto con el agua de mar.
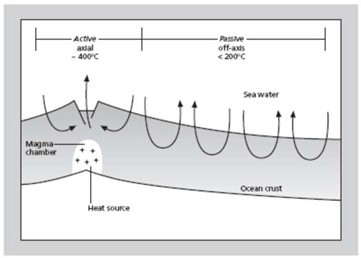
Con este resumen escueto de la geoquímica de las aguas marinas podemos llegar a entender una dinámica general de los ciclos y las interacciones naturales en las que, como ya sabemos,Los sistemas hidrotermales de alta temperatura son los denominados chimeneas negras o black smokers, y los de baja son las chimeneas hidrotermales alcalinas o chimeneas blancas (white smokers). En las primeras, esencialmente el proceso extrae Mg2+ y SO 2‐ del agua del mar y da al medio Ca2+, K+ y H4SiO4(aq). En las chimeneas alcalinas, aún son pocos los experimentos que han podido testificar el tipo de reacciones que justifiquen las medidas que se han realizado, por ejemplo, en el Atlántico con el descubrimiento de la llamada Lost City. Las reacciones que dominan en estos entornos de baja temperatura están relacionadas con el proceso de serpentinización del olivino en el que se libera H2, por lo que estos medios están siendo intensamente estudiados por ser muy probable que, en ambientes similares, hace unos 3800 ma, se pasara de la química inorgánica a la vida, ya que en ellos existe un gran flujo de nutrientes y energía.
Con este resumen escueto de la geoquímica de las aguas marinas podemos llegar a entender una dinámica general de los ciclos y las interacciones naturales en las que, como ya sabemos, hay un efecto de las actividades antrópicas. Estos impactos son evidentes tanto en los elementos mayores como en los menores.
Estos son los mayores impactos en los elementos mayores:
- El flujo de Cl‐ a los mares, procedente de los ríos, se ha incrementado en un 40% por las actividades humanas
- El flujo de SO 2‐ se ha duplicado, también como efecto antrópico, por la quema de combustibles fósiles y la oxidación del H2S procedente de la contaminación.
- Los mayores aportes de NO ‐, sin embargo, no tienen un efecto evidente en las aguas oceánicas, debido a que el océano es un gran reservorio de N. Su efecto en mares de menor tamaño si puede ser
En general, los efectos de los impactos son más evidentes en los mares de menor tamaño, ya que los procesos de mezcla en sus aguas son mucho más restringidos que en el océano. Las plataformas continentales cercanas a los centros de actividad humana son las zonas de los océanos que más sufren de los impactos. Los ríos que vierten a estas aguas pueden estar químicamente afectados por las actividades, pero también pueden transportar carga contaminante en suspensión.
Impactos terrestres importantes, como la deforestación y la actividad agrícola intensiva a escala mundial, tienen también su efecto sobre la composición de las aguas oceánicas. Debido a estos impactos hay un mayor aporte de sólidos detríticos en las cuencas marinas de las plataformas continentales lo que hace aumentar el intercambio iónico y las interacciones entre material sólido y agua marina. Aunque bien es cierto que el aumento, en los últimos años, de embalses y presas en los ríos está haciendo que estos aportes disminuyan. En las zonas tropicales, los ríos que llevan mayor carga de detríticos están haciendo que la producción biológica de los arrecifes de coral que reciben sus aguas disminuya, ya que la mayor carga en sólidos hace que descienda la claridad de las aguas.
Los estudiantes pueden complementar con dos casos regionales de los efectos antrópicos sobre el mar Báltico y el Golfo de México en el manual de Andrews et al. (2004).
Este artículo corresponde a un fragmento de uno de los módulos del “Curso de introducción a la geoquímica aplicada“.